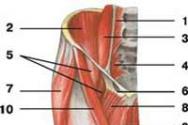
Свойства глюкозы как альдегида. Физико-химические свойства глюкозы
Урок в профильном химико-биологическом 10 классе
Цели: дидактические – обобщение и закрепление знаний о глюкозе, ее свойствах и практическом применении;
воспитывающие – воспитание самостоятельности, воли, сотрудничества, общительности, коммуникабельности;
развивающие (познавательные) – развитие внимания, памяти, речи, мышления, умения сравнивать, сопоставлять, находить аналоги, проявлять творческие способности, мотивировать учебную деятельность.
Форма урока – контрольно-обучающий семинар.
ХОД УРОКА
Учитель. На сегодняшнем уроке нам с вами предстоит выяснить, насколько хорошо вы разобрались с теоретическими вопросами, касающимися одного из важнейших представителей моносахаридов – глюкозы. А чтобы проверить это, мы проведем сейчас семинарское занятие. Вопросы для подготовки к семинару по теме «Глюкоза» вам были даны заранее, сейчас они лежат перед вами на столах (план семинара отпечатан отдельно).
Учитель. Ну что же, начнем работать по намеченному плану. Работаем, как всегда, в темпе, надо успеть проверить и закрепить очень многое.
Первый вопрос , который нам предстоит сейчас обсудить, а он – один из самых важных, касается химического строения глюкозы: какое химическое строение имеет глюкоза, какие функциональные группы входят в ее состав?
Второй вопрос , который предстоит разобрать, касается химических свойств глюкозы: глюкоза – соединение с двойственной функцией.
Давайте сразу договоримся, что все вы, присутствующие сегодня на семинаре, не должны быть сторонними наблюдателями. Пожалуйста, следите за ответами выступающих, задавайте вопросы, если они у вас возникнут по ходу ответов, исправляйте ошибки, если они будут допущены при ответах, чтобы при уходе с сегодняшнего занятия у вас не осталось никаких пробелов по теме «Глюкоза».
Для ответа на первый вопрос вызываю одного ученика, а на второй – двух, причем для ответа на второй вопрос предлагаю два различных по характеру задания.
Задание 1
Из предложенного многообразия химических реакций, характерных для различных классов органических соединений, выберите те, которые присущи глюкозе как многоатомному спирту. Запишите уравнения химических реакций, дайте названия продуктам реакций.
1) Взаимодействие со щелочами.
2) Взаимодействие с аммиаком.
3) Взаимодействие с галогеноводородами.
4) Дегидратация.
5) Взаимодействие с солями неорганических кислот.
6) Взаимодействие со свежеприготовленным гидроксидом меди(II) при обычных условиях.
7) Взаимодействие со спиртами с образованием гликозидов.
8) Окисление под действием сильных окислителей (азотной кислоты).
9) Дегидрирование.
Дополнительный вопрос . Какие еще реакции характерны для глюкозы как многоатомного спирта?
Задание 2 (экспериментальная задача)
Докажите опытным путем с помощью предложенных реактивов, что изюм содержит глюкозу. Проведите соответствующие химические реакции, отметьте их признаки. Запишите уравнения химических реакций и назовите их продукты.
Дополнительные вопросы . 1) Какие еще известны вам вещества, для которых характерна двойственность химических свойств? 2) К какому типу химических реакций относится реакция глюкозы с аммиачным раствором оксида серебра(I)?
Учитель. Пока идет подготовка к ответам на поставленные вопросы, мы времени зря терять не будем, а вспомним все химические понятия, которые вы должны знать по теме «Глюкоза» и без которых невозможно изучение в дальнейшем всей темы «Углеводы». Я называю химическое понятие, а вы даете ему быстро краткую и четкую формулировку, т.е. сейчас мы проведем химическую понятийную разминку.
Для химической разминки вызываю трех учащихся, им дается по пять химических терминов каждому по очереди. Если они не отвечают, спрашиваю у остальных учащихся класса, выставляю оценки в зависимости от того, кто и сколько дал правильных ответов.
Химическая понятийная разминка (химические понятия, которые предлагались учащимся)
1) У г л е в о д ы – класс
полигидроксикарбонильных соединений,
отвечающий общей формуле
C n
(H 2 O) m
, где n
, >
l 3.
2) Ф о т о с и н т е з – процесс, проходящий в хлоропластах под действием солнечного света, в результате которого из углекислого газа и воды образуются углеводы и выделяется кислород.
3) Б р о ж е н и е – расщепление моносахаридов под влиянием биологических катализаторов (ферментов, вырабатываемых микроорганизмами).
4) А л ь д о з ы – моносахариды с альдегидной группой.
5) Г и д р и р о в а н и е – присоединение водорода.
6) П и р а н о з н ы е с т р у к т у р ы – шестичленные циклы, включающие атом кислорода.
7) В и н о г р а д н ы й с а х а р – глюкоза.
8) А ц и л – кислотный радикал карбоновой кислоты.
9) Ф р у к т о з а – изомер глюкозы.
10) Х е л а т н ы е с о е д и н е н и я – комплексные соли, в молекулах которых атом металла образует как обычные ковалентные связи, так и донорно-акцепторные.
11) -Г л ю к о з а – циклическая форма глюкозы, в которой гидроксильная группа первого атома углерода находится под плоскостью кольца.
12) Г и б р и д и з а ц и я – явление смешения электронных облаков, выравнивание их по форме и энергии.
13) Г л и к о з и д н ы й г и д р о к с и л (полуацетальный) – гидроксил при первом атоме углерода в - и -циклической формах глюкозы.
14) О к с о ц и к л о т а у т о м е р и я – обратимая циклизация линейных форм в циклические.
15) Г и д р о л и з – процесс разложения веществ в результате обменного взаимодействия между молекулами вещества и молекулами воды.
16) М о н о с а х а р и д ы – углеводы, которые содержат в углерод-углеродных цепях от трех до шести атомов углерода и не способны подвергаться гидролизу.
17) К е т о з ы – моносахариды с кетогруппой.
18) Ф у р а н о з н ы е с т р у к т у р ы – пятичленные циклы, включающие атом кислорода.
Учитель. Переходим к третьему вопросу : специфическое свойство глюкозы – брожение .
Для ответа на третий вопрос вызываю двух учащихся, им даются разные по характеру задания.
Задание 1
Полученное при брожении глюкозы соединение С 3 Н 6 О 3 в реакции с натрием образует соединение состава С 3 Н 4 Na 2 О 3 , c карбонатом кальция – С 6 Н 10 СаО 6 . Назовите это соединение и напишите уравнения соответствующих реакций.
Ответ .

Задание 2
Напишите уравнение реакции спиртового брожения глюкозы. Вычислите, какой объем оксида углерода(IV) (н.у.) образуется при спиртовом брожении 1 моль глюкозы.
Ответ.
![]()
Учитель. Пока идет подготовка к ответу на третий вопрос, я буду вам задавать вопросы по теме «Глюкоза», а вы – давать мне устные ответы на них.
Вывешивается схема «Таутомерия D-глюкозы» (cм. с. 42). Схема нарисована заранее на листе ватмана (никаких подписей на схеме нет).
Вопросы
1) Почему у глюкозы не наблюдается всех химических свойств, характерных для альдегидов?
Ответ
. В растворе глюкозы
содержится не только альдегидная форма,
но и четыре способные переходить друг в друга
циклические формы,
в которых нет альдегидной группы атомов.
2) Какая это форма глюкозы? (Учитель показывает на схеме и спрашивает.)
Ответ . Альдегидная.
3) В каком гибридном состоянии находится атом углерода альдегидной группы? (Учитель показывает на схеме и спрашивает.)
Ответ . Гибридизация sp 2 .
Схема

4) Чью формулу используют для изображения ациклической структуры глюкозы?
Ответ . Формулу Фишера.
5) За счет чего происходит образование циклической формы глюкозы?
Ответ
. Образование циклической
формы возможно за счет
внутримолекулярного взаимодействия альдегидной
группы атомов с гидроксильной группой
при пятом или четвертом атоме углерода.
6) Как называются циклические формы глюкозы?
Ответ
. -D- и
-D-глюкопираноза,
-D- и
-D-глюкофураноза
.
7) Как называется гидроксил при первом атоме углерода в циклической форме глюкозы?
Ответ . Гликозидный.
8) Чем отличаются -D- и -D-глюкопираноза друг от друга?
Ответ
. Различным расположением
гидроксильной группы при
первом атоме углерода – под и над плоскостью
цикла.
9) Чем по отношению друг к другу являются все формы глюкозы?
Ответ . Изомерами-таутомерами.
10) Какая изомерия характерна для глюкозы?
Ответ . Оксоциклотаутомерия .
11) Кем были предложены формулы, имеющие контур прямоугольника?
Ответ . Толленсом .
12) Формулы Толленса неудобны, громоздки, не отображают истинного химического строения. По этим причинам формулами какого ученого принято изображать циклические формы глюкозы?
Ответ . Хеуорса .
13) Какая форма глюкозы наиболее предпочтительна в растворе глюкозы?
Ответ . Форма -D-глюкопиранозы – 68%.
Учитель оценивает учащихся, ответивших на большее число вопросов.
Учащимся выставляются оценки.
Учитель. Итак, нам с вами осталось разобрать последний, четвертый вопрос семинара, но не менее важный: применение глюкозы . Вы знаете, что на уроках химии мы изучаем те вещества, которые находят практическое применение. Глюкоза не является исключением.
Как мы сейчас с вами поступим? Я буду задавать вопросы и приводить три варианта ответа к каждому из них, которые касаются применения как самой глюкозы, так и продуктов ее реакций. Но не надо забывать, что многие из вас уже определили свою будущую профессию – это врач. Поэтому вопросы о применении глюкозы будут касаться вашего профиля. Если кто-то не отвечает на поставленный вопрос, его заменяет следующий желающий.
Как я буду вас оценивать? А на основе применения глюкозы. Глюкоза обладает способностью образовывать устойчивые сиропы, что используется в кондитерской отрасли промышленности, точнее, в производстве карамелей и леденцов. За каждый правильный ответ вы получаете производное глюкозы – конфету. (Была куплена карамель.) Кто же первым хочет попробовать свои силы в ответах на вопросы о применении глюкозы?
Вопросы
1) В начале XX в. доктора уже знали, что сахар – это «белая смерть», однако очень медленная и сладкая. Те же доктора, хорошенько изучив таблицу Д.И.Менделеева, нашли несколько полноценных заменителей сахара, не отличающихся от него по вкусу, но не вызывающих диабета и разрушения зубов.
Как называется один из заменителей сахара?
В а р и а н т ы о т в е т а . Пинакон, сорбит , глицерин.
2) Кровоточивость десен, язвы на слизистой рта, расшатывание и выпадение зубов, покрытие тела кровоподтеками – это признаки болезни – цинги.
При недостатке какого витамина в организме развивается эта мучительная болезнь?
В а р и а н т ы о т в е т а . С , D, A.
3) Как называется заболевание суставов, обусловленное нарушением обмена мочевой кислоты в организме, причиной которого является молочная кислота?
В а р и а н т ы о т в е т а . Ревматизм, радикулит, подагра .
4) Обыкновенная лягушка может провести зиму, вмерзнув в лед, а весной возвращается к жизни. Это явление основано на повышенном содержании в ее крови какого углевода?
В а р и а н т ы о т в е т а . Глюкозы , фруктозы, галактозы.
5) Как называют соль, которую применяют в медицинской практике при аллергических, кожных заболеваниях, легочных и носовых кровотечениях, при усиленном выделении кальция из организма?
В а р и а н т ы о т в е т а . Глюконат кальция , ацетат свинца, глицерат меди.
6) Продуктом одного из типов брожения глюкозы является вещество, которое применяется как раздражающее средство для обтираний, компрессов. Какое это вещество?
В а р и а н т ы о т в е т а . Метанол, этанол , бутанол.
7) Какой изомер глюкозы, за счет которого сперматозоиды получают энергию, синтезируется в семенных пузырьках?
В а р и а н т ы о т в е т а . Фруктоза , манноза, галоза.
8) Глюкоза применяется в производстве зеркал и елочных украшений. Какой тип xимических реакций лежит в основе этого производства?
В а р и а н т ы о т в е т а . Замещение, окисление , присоединение.
(П р и м е ч а н и е. Правильные ответы в тексте подчеркнуты.)
Варианты ответов написаны на альбомных листах, все они выставляются перед учениками. Учитель читает вопрос и дает три варианта ответа к нему.
Учитель. Итак, мы с вами разобрали все вопросы семинарского занятия, и теперь, я думаю, вы окончательно устранили многие пробелы по теме «Глюкоза».
Задание на дом. Подготовиться к диктанту по теме «Глюкоза».
Вариант 1.
В. Глюкоза.
2. Общая формула предельных углеводородов:
В. CnH2n+2
3. Формула этиленового углеводорода, содержащего 5 атомов углерода:
Б. С5Н10
4.Гомологом метана является вещество, формула которого:
А. СН3-СН2-СН3.
5. Изомером углеводорода, имеющего формулу СН3-СН2-СН2-СН2-СН3, является вещество с формулой:
А. СН3-СН-СН2-СН3.
СН3
6. Формула альдегида:
А. СН3С =О
-Н
7. Объем углекислого газа, образовавшегося при сгорании 2 л пропана:
В. 6 л.
8. Формулы продуктов полного сгорания метана:
Б. С02 и Н20.
9. Для этилена характерной является реакция:
В. Гидратации.
10. Свойство, не характерное для глюкозы:
A. Проводит электрический ток в растворе.
11. Установите соответствие.
Класс соединения:
1. Одноатомные спирты.
2. Карбоновые кислоты.
3. Альдегиды.
4. Предельные углеводороды.
1Б, 2А, 3В, 4Д
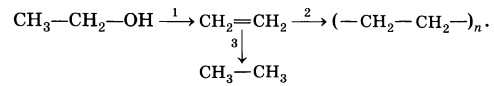
1. CH3-CH2-OH=>CH2=CH2+H2O. Реакция идет при нагревании и присутствии серной кислоты.
2. nСН2=СН2 -> (-СН2-СН2-)n
3. CH2=CH2+H2=> CH3-CH3
р.полимеризации
14. Для вещества с формулой
СН2=СН-сн2-сн3
а) одного гомолога;
б) одного изомера.
СН₂=СН-СН₃ пропен
CH3-CH2=CH-CH3 бутен 2
15. Дополните фразу: «Гомологи - это...»
ряд химических соединений одного структурного типа, отличающихся друг от друга по составу на определенное число повторяющихся структурных единиц - так называемую гомологическую разность
Вариант 2.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Органическим веществом является:
В. Метиловый спирт.
2. Общая формула этиленовых углеводородов:
А. СnН2n
Г. C7H16.
А. СН3-СН2-СН3.
А. СН3-СН=СН-СН2-СН3.
6. Формула предельного одноатомного спирта:
В. СН3-СН2ОН.
7. Объем кислорода, необходимый для сгорания 4 л этана:
Г. 14 л.
8. Уксусная кислота не взаимодействует с веществом, формула которого:
А. Сu.
9. Для метана характерной является реакция:
Б. Замещения.
10. Свойство, характерное для крахмала:
A. В горячей воде образует коллоидный раствор.
11. Установите соответствие.
Класс соединения:
1. Одноатомные спирты.
2. Карбоновые кислоты.
3. Альдегиды.
4. Предельные углеводороды.
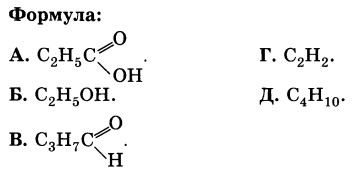
1Б, 2А, 3В, 4Д
ЧАСТЬ Б. Задания со свободным ответом
12. Запишите уравнения реакций, с помощью которых можно осуществить превращения:
СаС2 -> С2Н2 -> СН3СНО -> СН3СН2ОН.
3. СН3-CH=O + Н2 → СН3-CH2-OH
14. Для вещества с формулой
СН2=СН-СН2-СН2-СН3
напишите структурные формулы:
а) одного гомолога;
б) одного изомера.
СН2=СН-СН2-СН3 бутен-1
CH3-CH=CH-CH2-CH3 пентен-2
Вариант 3.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Органическим веществом является:
В. Муравьиная кислота.
2. Формула бутана:
Г. С4Н10.
3. Формула предельного углеводорода, содержащего 5 атомов углерода:
В. С5Н12.
4. Гомологом этилена является вещество с формулой:
Б. СН2=СН-СН3.
5. Изомером углеводорода, имеющего формулу СН3-СН2-СН2-СН3, является вещество с формулой:
В. СН3-СН-СН3.
СН3
6. Формула сложного эфира:
Г. НСООСН3.
7. Объем углекислого газа, образовавшегося при сгорании 5 л пропана:
В. 15л.
8. Этиловый спирт взаимодействует с веществом, формула которого:
В. СuО.
9. Для пропана характерной является реакция:
Б. Замещения.
10. Свойство, характерное для жиров:
Б. Подвергаются гидролизу.
11. Установите соответствие.
Класс соединений:
1. Одноатомные спирты.
2. Карбоновые кислоты.
3. Альдегиды.
4. Предельные углеводороды.
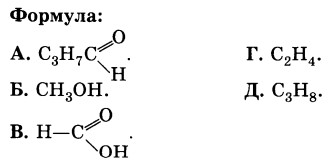
1Б, 2В, 3А, 4Д
ЧАСТЬ Б. Задания со свободным ответом
12. Запишите уравнения реакций, с помощью которых можно осуществить превращения:
С2Н2 -> С2Н4 -> С2Н6 -> С2Н5Сl.
1.С2Н2 + Н2 →С2Н4
2. С2Н4 + Н2 →С2Н6
3. CH3-CH3 +Cl2-> CH3-CH2 Cl + HCl
13. Укажите тип реакции превращения 2 из задания 12.
гидрирование этилена
14. Для вещества с формулой
СН3-СН2-СН2-СН3
напишите структурные формулы:
а) одного гомолога;
б) одного изомера.
CH3- CH2-CH3 пропан
СН3-СН (СН3)-СН3 2-метилпропан
15. Дополните фразу: «Углеводороды - это...»
органические соединения, состоящие исключительно из атомов углерода и водорода.
Вариант 4.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Органическим веществом является:
Б. Крахмал.
2. Общая формула спиртов:
Г. CnH2n+1OH.
3. Формула предельного углеводорода, содержащего 7 атомов углерода:
Г. С7Н16.
4. Гомологом этана является вещество с формулой:
А. СН3-СН2-СН3.
5. Изомером углеводорода, имеющего формулу СН2=СН-СН2-СН2-СН3, является вещество с формулой:
A. СН3-СН=СН-СН2-СН3.
6. Формула карбоновой кислоты:
Б. СН3-СООН.
7. Объем кислорода, необходимый для сгорания 2 л этана:
Г. 7 л.
8. Этилен не взаимодействует с веществом, формула которого:
Г. СН4.
9. Для этана характерной является реакция:
Б. Замещения.
10. Свойство, не характерное для крахмала:
Г. Растворяется в воде.
11. Установите соответствие.
Класс соединений:
1. Одноатомные спирты.
2. Карбоновые кислоты.
3. Альдегиды.
4. Предельные углеводороды.
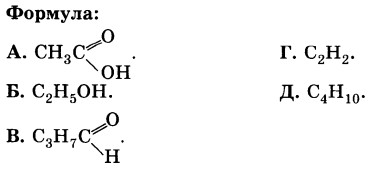
1Б, 2А, 3В, 4Д.
ЧАСТЬ Б. Задания со свободным ответом
12. Запишите уравнения реакций, с помощью которых можно осуществить превращения:
СаС2 -> С2Н2 -> СН3СНО -> СН3СН2ОН.
1. CaC2 + 2H2O → Ca(OH)2 + C2H2
2. CH≡CH + H2O Hg2+,H+→ → CH3-CH=O
3. СН3-CH=O + Н2 → СН3-CH2-OH
13. Укажите тип реакции превращения 3 из задания 12.
Гидрирование (Восстановление карбонильных соединений)
14. Для вещества с формулой
СН2=СН-СН2-СН2-СН3
напишите структурные формулы:
а) одного гомолога;
б) одного изомера.
СН2=СН-СН2-СН3 бутен-1
CH3-CH=CH-CH2-CH3 пентен-2
15. Дополните фразу: «Одноатомные спирты - это...»
органические соединения, содержащие одну гидроксильную группу, непосредственно связанную с насыщенным атомом углерода.
Введение
Глава 1. Обзор литературы
1.1. Получение глюкозы
1.3. Подлинность
Общие выводы
Список литературы
Введение
Глюкоза
Получение глюкозы

Подлинность
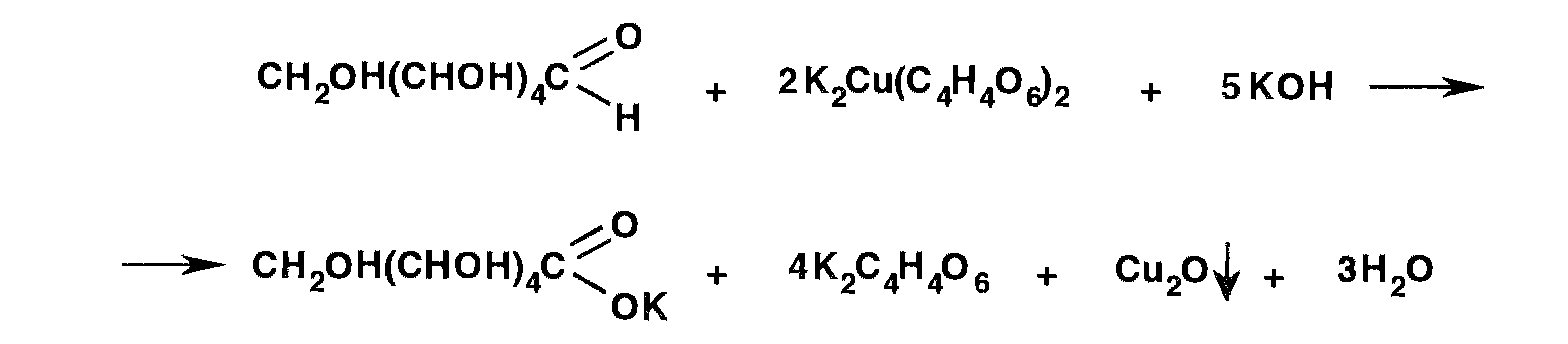

Количественное содержание препарата определяют иодиметрически: точную навеску глюкозы (0,500 г) помещают в мерную колбу вместимостью 100 мл, растворяют в воде, доводят растворителем до метки.
К 5мл полученного раствора прибавляют 10 мл 0,1 М раствора иода, 10-15 мл 1% раствора натрия гидроксида и оставляют на 10-15 мин. Затем к раствору добавляют 10 мл кислоты серной разведенной и титруют 0,1 М раствором натрия тиосульфата в присутствии крахмала до обесцвечивания раствора.
![]() ,где
,где
К- поправочный коэффициент,
Т- титр титранта по определяемому веществу,
а- навеска исследуемого образца.
Применение раствора глюкозы
В медицинских целях применяют изотонические (4,5-5%) и гипертонические (10-40%) растворы.
Изотонический раствор используют для возмещения дефицита воды в организме, вместе с тем он является источником легко усвояемого организмом ценного питательного материала. При сгорании глюкозы в тканях выделяется значительное количество энергии, которая служит для осуществления функций организма.
При введении в вену гипертонических растворов повышается осмотическое давление крови, усиливается ток жидкости из тканей в кровь, стимулируются процессы обмена веществ, улучшается детоксикационная функция печени, возрастает сократительная деятельность сердечной мышцы, расширяются сосуды, увеличивается диурез.
Растворы глюкозы широко применяют в медицинской практике при гипогликемии, болезнях печени (гепатите, дистрофии печени), токсикоинфекциях, разных интоксикациях (отравлениях наркотиками, синильной кислотой и ее солями, окисью углерода, анилином, мышьяковистым водородом, фосгеном и другими веществами) и иных патологических состояниях, а также при шоке и коллапсе; кроме того, они являются компонентами различных кровезамещающих и противошоковых жидкостей и используются для разведения ЛС при введении их в вену.
Изотонические растворы применяют подкожно (300-500 мл и более), внутривенно капельно (до 2-6 л в сутки) и в клизмах (300-500 мл).
Гипертонические растворы вводят вводят внутривенно по 20-50 мл; при необходимости капельно – до 1-3 л в сутки. Часто глюкозу назначают в сочетании с аскорбиновой кислотой.
Таблица 3. – Результаты титрования
Строим градуировочный график:
| С,г |

График 1. Зависимость объема титранта от концентрации.
Рассчитываем коэффициент корреляции:
Заключение: Таким образом результаты оценки методики показывают, что зависимость объема титранта от концентрации глюкозы в растворе является линейной.
Таблица 4. Результаты испытаний
| Уровень | Взято, г | ,мл | Найдено, г | Х, % | (Х i -Х ср) 2 |
| н | 0,02504 | 2,6 | 0,0252252 | 100,74 | 0,1936 |
| н | 0,02504 | 2,6 | 0,0252252 | 100,74 | 0,1936 |
| н | 0,02504 | 2,5 | 0,0244255 | 96,87 | 11,7649 |
| с | 0,05008 | 5,3 | 0,0514206 | 102,68 | 5,6644 |
| с | 0,05008 | 5,2 | 0,0504504 | 100,74 | 0,1936 |
| с | 0,05008 | 5,3 | 0,0514206 | 102,68 | 5,6644 |
| в | 0,07512 | 7,7 | 0,0747054 | 99,45 | 0,7225 |
| в | 0,07512 | 7,8 | 0,0756756 | 100,74 | 0,1936 |
| в | 0,07512 | 7,6 | 0,0737352 | 98,16 | 4,5796 |
| Х ср =100,3 |
![]() ;
;
![]() ; SD=1,9095;
; SD=1,9095;
![]() ; RSD=1,9%
; RSD=1,9%
Заключение: полученные результаты показывают, что методика является валидной по показателю "Прецизионность" в условиях повторяемости; случайная ошибка незначительна (1,9%).
Таблица 5. – Приготовление модельных растворов глюкозы.
Раствор А 1. Точную навеску глюкозы (0,4 г) помещают в мерную колбу вместимостью 10 мл, растворяют в 5 мл воды очищенной, добавляют 0,1 М раствор кислоты хлористоводородной до pH 3,0-4,0 и доводят водой до метки.
Раствор А 2. Точную навеску глюкозы (0,5 г) помещают в мерную колбу вместимостью 10 мл, растворяют в 5 мл воды очищенной, добавляют 0,1 М раствор кислоты хлористоводородной до pH 3,0-4,0 и доводят водой до метки.
Раствор А 3. Точную навеску глюкозы (0,6 г) помещают в мерную колбу вместимостью 10 мл, растворяют в 5 мл воды очищенной, добавляют 0,1 М раствор кислоты хлористоводородной до pH 3,0-4,0 и доводят водой до метки.
Растворы Б 1 , Б 2 , Б 3 . В три колбы для титрования переносят по 1,0 мл раствора А 1 , прибавляют 10 мл воды, 10 мл 0,05 М раствора иода, 3 мл 10% раствора натрия гидроксида. Закрывают склянку пробкой и оставляют на 5 минут в темном месте. Затем прибавляют 5 мл кислоты серной разведенной и титруют 0,1 М раствором натрия тиосульфата до обесцвечивания раствора (индикатор - крахмал).
Растворы Б 4 , Б 5 , Б 6 . В три колбы для титрования переносят по 1,0 мл раствора А 2 , прибавляют 10 мл воды, 10 мл 0,05 М раствора иода, 3 мл 10% раствора натрия гидроксида. Закрывают склянку пробкой и оставляют на 5 минут в темном месте. Затем прибавляют 5 мл кислоты серной разведенной и титруют 0,1 М раствором натрия тиосульфата до обесцвечивания раствора (индикатор - крахмал).
Растворы Б 7 , Б 8 , Б 9 . В три колбы для титрования переносят по 1,0 мл раствора А 3 , прибавляют 10 мл воды, 10 мл 0,05 М раствора иода, 3 мл 10% раствора натрия гидроксида. Закрывают склянку пробкой и оставляют на 5 минут в темном месте. Затем прибавляют 5 мл кислоты серной разведенной и титруют 0,1 М раствором натрия тиосульфата до обесцвечивания раствора (индикатор - крахмал).
1 мл 0,05 М раствора иода соответствует 0,0099 г водной глюкозы.
Параллельно проводят контрольный опыт.
X найдено = ×K×T, где
V k - объем титранта, пошедший на титрование в контрольном опыте,
V-объем титранта, пошедший на титрование в исследуемом образце,
К- поправочный коэффициент,
Т- титр титранта по определяемому веществу.
Результаты оценки методики количественного определения по показателю «Правильность» занесли в таблицу 6.
Таблица 6. – Результаты испытаний
| Уровень | Взято, г | ,мл | Найдено, г | Х, % | (100-Х i) 2 |
| н | 0,04008 | 6,9 | 0,03978 | 99,25 | 0,5625 |
| н | 0,04008 | 6,8 | 0,04075 | 101,67 | 2,7889 |
| н | 0,04008 | 6,9 | 0,03978 | 99,25 | 0,5625 |
| с | 0,05000 | 5,9 | 0,04948 | 99,56 | 0,1936 |
| с | 0,05000 | 6,0 | 0,04851 | 97,02 | 8,8804 |
| с | 0,05000 | 5,9 | 0,04948 | 99,56 | 0,1936 |
| в | 0,06004 | 4,9 | 0,05918 | 98,57 | 2,0449 |
| в | 0,06004 | 5,0 | 0,05821 | 96,95 | 9,3025 |
| в | 0,06004 | 4,8 | 0,06015 | 100,18 | 0,0324 |
| Х ср =99,11 |
![]() ;
;
![]() ; SD=1,752;
; SD=1,752;
![]() ; =1,52
; =1,52
Заключение: сравнивая полученные результаты с табличными значениями можно сделать вывод о том, что методика является валидной по показателю «Правильность».
Общие выводы :
Глюкоза - это очень важный углевод, применяемый в самых различных областях. Важное место глюкоза занимает в медицине, как детоксикант и средство для парентерального питания.
В литературном обзоре были рассмотрены характеристика и свойства глюкозы, её получение, качественные реакции и методы количественного определения, а также практическое применение.
В экспериментальной части приведена валидационная оценка методик качественного и количественного анализа раствора глюкозы для инъекций по показателям: «специфичность», «линейность», «прецизионность», «правильность».
Полученные результаты позволяют сделать вывод, что представленные методики пригодны для практического использования и могут быть использованы для качественного и количественного анализа раствора глюкозы для инъекций.
Список литературы
1. Беликов, В.Г. Фармацевтическая химия. В 2 ч.: Ч.1. Общая фармацевтическая химия; Ч.2. Специальная фармацевтическая химия: Учеб. для вузов. – Пятигорск, 2003. – 720 с.
2. Машковский, М.Д. Лекарственные средства. – 16-е изд., перераб., испр., и доп. – М.: Новая волна: Издатель Умеренков, 2010. – 1216 с.
3. ОФС 42-0113-09 «Валидация аналитических методик»
4. Государственная фармакопея СССР. – Х изд.
5. Руководство к производственной практике по внутриаптечному контролю качества лекарственных средств: учебное пособие / Е.В. Компанцева, Т.Т. Лихота, Г.И. Лукъянчикова, Г.В. Сенъчукова / под редакцией Е.В. Компанцевой. – Пятигорск, 2006.-268 с.
6. Арзамасцев, А.П. Валидация аналитических методов / А.П. Арзамасцев, Н.П. Садчикова, Ю.Я. Харитонов // Фармация. -2006. –Т.55, №4. – С.8-12.
Введение
Глава 1. Обзор литературы
1.1. Получение глюкозы
1.2. Физико-химические свойства глюкозы
1.3. Подлинность
1.4. Испытание на чистоту раствора глюкозы
1.5. Количественное определение
1.6. Применение раствора глюкозы
1.7. Выводы по обзору литературы
Глава 2. Практическая часть. Валидационная оценка методик качественного и количественного анализа раствора глюкозы для инъекций 5%
2.1. Валидационная оценка методик анализа раствора глюкозы для инъекций по показателю «Специфичность»
2.2. Валидационная оценка методик титриметрического анализа раствора глюкозы для инъекций по показателю «Линейность»
2.3. Валидационная оценка методик титриметрического анализа раствора глюкозы для инъекций по показателю «Прецизионность»
2.4. Валидационная оценка методик титриметрического анализа раствора глюкозы для инъекций по показателю «Правильность»
Общие выводы
Список литературы
Введение
Валидация – экспериментальное доказательство пригодности методики для решения поставленной задачи. Валидация методик проводится на этапе подготовки НД на новые ЛС или пересмотре их в дальнейшем.
Цель работы: провести валидационную оценку методик качественного и количественного анализа раствора глюкозы для инъекций по нескольким показателям.
Изучить показатели качества раствора глюкозы для инъекций по литературным источникам;
Экспериментально провести валидационную оценку методик качественного и количественного анализа раствора глюкозы для инъекций по показателям: «специфичность», «линейность», «прецизионность», «правильность»;
Подвести итоги валидационной оценки методик качественного и количественного анализа раствора глюкозы для инъекций.
Глюкоза
Получение глюкозы
(C 6 H 10 O 5) n + n H 2 O → n C 6 H 12 O 6
Глюкозу также можно получить гидролизом сахарозы с участием спиртового раствора хлороводорода. Глюкоза выкристаллизовывается, а фруктоза остается в растворе.

Раствор глюкозы для инъекций готовят следующим образом: к 50, 100, 250 или 400 г глюкозы безводной добавляют раствор соляной кислоты 0,1 М до рН 3,0 – 4,0; 0,26 г натрия хлорида и воды для инъекций до 1 л. Раствор фильтруют, разливают в ампулы из нейтрального стекла по 10, 20, 25 или 50 мл и стерилизуют паром при температуре 100 о С в течение 60 минут или насыщенным паром при температуре 119-121 о С в течение 5-7 минут.
Физико-химические свойства глюкозы
Бесцветные кристаллы или белый мелкокристаллический порошок без запаха, сладкого вкуса. Легко растворим в воде, трудно растворим в 95% этаноле, практически нерастворим в эфире и хлороформе. Удельное вращение от +52 до +53 о (10% водный раствор).
Подлинность
Реакция подлинности на глюкозу основана на ее способности окисляться.
К раствору 0,2 г препарата в 5 мл воды прибавляют 10 мл реактива Фелинга и нагревают до кипения; выпадает кирпично-красный осадок.
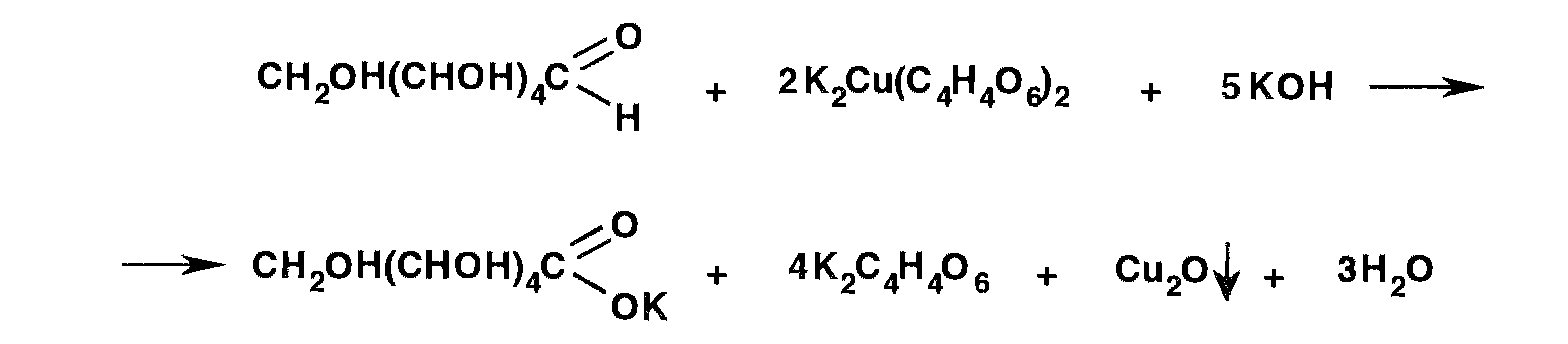
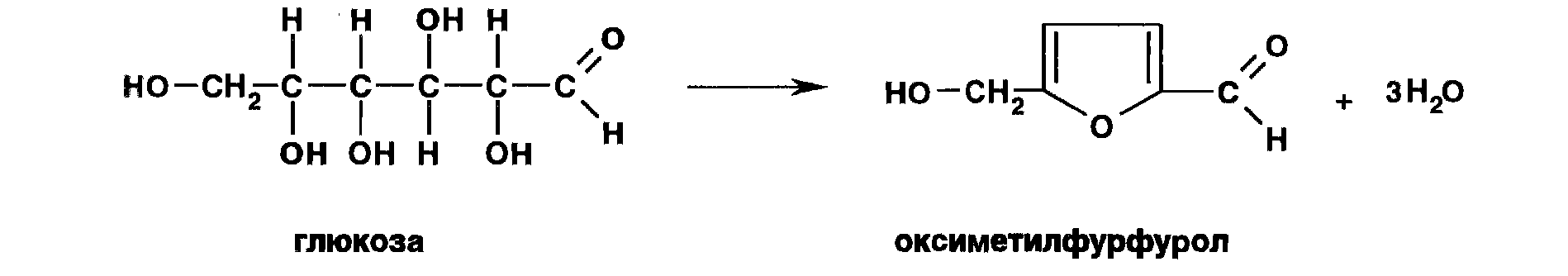
Под воздействием минеральных кислот или щавелевой кислоты глюкоза превращается при нагревании в пробирке на пламени горелки в фурфурол или его производые:

Фурфурол или оксиметилфурфурол, являясь летучими соединениями, взаимодействуют с анилином или прокаином, нанесенным на фильтровальную бумагу, которой накрывают пробирку. Вначале образуется основание Шиффа, имеющее светло-желтую окраску, а затем фурановый цикл раскрывается и получается полиметиновый краситель – производное оксиглютаконового альдегида (малиново-фиолетовое окрашивание):