Подсчет клеток в камере горяева формула. Камера Горяева. Практическое применение
Сегодня камера Горяева является одним из самых используемых приспособлений в лабораторной диагностике. С ее помощью можно подсчитать количество тех или иных кровяных клеток. Как известно, анализ крови крайне важен для процесса диагностики и лечения почти каждого заболевания.
Что такое Камера Горяева?
Столь известное и полезное приспособление было разработано и предложено русским врачом Н. К. Горяевым. Камера Горяева, по сути, представляет собой специфическое предметное стекло с нанесенной на него микроскопической сеткой.
Для чего используется эта камера? В первую очередь с ее помощью определяют количество кровяных клеток, в частности лейкоцитов и эритроцитов. Кстати, с ее же помощью можно определить увеличение используемого микроскопа. Формула для этого выглядит следующим образом:
- Kg = (m2 - m1)/ aN
В данном случае:
- Kg — это увеличение микроскопа;
- m2 — положение правой границы клетки камеры Горяева;
- m1 — положение левой границы;
- а — размер одной клетки, который является стандартным и составляет 0,05 мм;
- N — это количество клеток между измеряемыми границами камеры.
Строение камеры
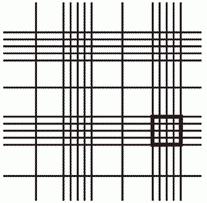
Камера Горяева представляет собой не что инное, как предметное стекло (но намного толще обычного), разделенное поперечными бороздами на три части. Средняя часть стекла содержит специальную сетку для подсчета. Крайние же части камеры служат для притирания покровного стекла — таким образом, по центру создается закрытая камера с капиллярными пространствами по бокам, через которые она и заполняется жидкостью.
Что же касается сетки, то камера Горяева разделена на 225 больших квадратов равных размеров — расположены они в пятнадцать рядов. 25 больших квадратов дополнительно разделены на меньшие, по 16 в каждом. Длина каждой стороны этого маленького квадратика составляет 0,05 мм.
Подготовка к подсчету форменных элементов
Безусловно, в данном случае огромное значение имеет техника проведения лабораторного исследования. Конечно же, все поверхности камеры Горяева должны быть чистыми и сухими. После этого покровное стекло притирают так, чтобы можно было увидеть характерные радужные кольца. Крайне важно, чтобы в камере не было пузырьков воздуха, так как это может исказить результаты анализа.
Естественно, для того чтобы подсчитать количество форменных элементов, для каждой разновидности кровяных клеток используются разные реактивы. Например, для подсчета эритроцитов используется 0,9% раствор натрия хлорида. В пробирке нужно смешать 8 мл раствора соли и 0,02 мл крови. Так, лаборант разбавляет кровь в 400 раз. Иногда разведение может быть большим.
После того как компоненты перемешаются в пробирке, с помощью специальной пипетки набирают небольшое количество смеси и аккуратно заполняют камеру для счета (как правило, одной или двух капель будет вполне достаточно).
Как правильно рассчитать количество кровяных клеток?

Подсчет эритроцитов в камере Горяева осуществляется в пяти больших квадратах, что равно восьмидесяти малым. Для того чтобы избежать ошибки из-за неравномерного распределения образцов крови, выбирают квадраты, расположенные по диагонали. Отдельное внимание обращают на клетки, расположенные по краям, — здесь считают эритроциты на левой и верхней стенках, но не берут во внимание те, которые расположены на нижней и правой линиях.
Для того чтобы определить количество эритроцитов в миллилитре крови, число клеток в пяти больших квадратах умножают на 20 000 (при разведении в 400 раз).
Лейкоциты в камере Горяева считают по-другому. Здесь нужно вычислить количество элементов по меньшей мере в сотне больших квадратов. Полученное количество делят на 1600, после чего умножают на 4000, а затем на 20 (степень разведения).
Для проведения данных исследований необходимо следующее оснащение рабочего места:
- Смесители для эритроцитов и лейкоцитов.
- Пробирки типа серологических.
- Пипетки на 1 и 5 мл.
- Капилляры к гемометру Сали.
- Стеклянные палочки.
- Глазные пипетки.
- Счетные камеры Горяева со шлифованными стеклами к ним.
- Микроскопы.
- Колбочки с чистой водой.
- Поваренная соль.
- Сулема.
- Сернокислый натрий.
- Ледяная уксусная кислота.
- 96° этиловый спирт.
- Генцианвиолет (метиленовая синька).
- Набор для взятия крови из пальца.
Взятие крови в смесители для подсчета эритроцитов и лейкоцитов
Для подсчета количества эритроцитов и лейкоцитов необходимы следующие реактивы:
- 3% раствор хлористого натрия (NaCl) : 3 г хлористого натрия помещают в колбочку на 100 мл и доливают дистиллированной водой до метки 100 мл.
- Реактив Гайема: к 0,5 г сулемы, 1 г хлористого и 5 г сернокислого натрия приливают 200 мл дистиллированной воды. Оба реактива сохраняют эритроциты.
- 3% раствор уксусной кислоты - 3 мл ледяной уксусной кислоты помещают в цилиндр на 100 мл и доливают дистиллированной водой до метки. Реактив подкрашивают 1% водным раствором генцианвиолета из расчета 5-6 капель краски на 10 мл 3% уксусной кислоты.
Кровь для подсчета эритроцитов и лейкоцитов берут в специальные смесители или в пробирки.
На чистый и сухой смеситель для эритроцитов надевают резиновую трубочку со стеклянным мундштуком, после чего в него насасывают кровь, без пузырьков воздуха, точно до метки 0,5, затем этим же смесителем набирают 3% раствор хлористого натрия или реактив Гайема точно до метки 101, не допуская появления пузырьков воздуха. При этом кровь разводится в 200 раз. Со смесителя снимают резиновую трубочку, захватывают его между пальцами, несколько раз встряхивают, прокалывают им бумажку, на которой указана фамилия больного, и кладут его на стол в горизонтальном положении.
В чистый сухой смеситель для лейкоцитов таким же способом, как и в смеситель для эритроцитов, насасывают кровь до метки 0,5, после чего тем же смесителем набирают 3% раствор уксусной кислоты до метки 11. При этом кровь разводится в 20 раз. Затем со смесителя снимают резиновую трубочку, несколько раз встряхивают его, прокалывают им бумажку, на которой указана фамилия больного, и кладут на стол в горизонтальном положении.
Взятие крови в пробирки для подсчета эритроцитов и лейкоцитов по Н. М. Николаеву
Для каждого взятия крови берут две нумерованные пробирки, серологическую и агглютинационную. В серологическую пробирку помещают 4 мл 3% раствора хлористого натрия или реактива Гайема, а в агглютинационную - 0,4 мл 3 % раствора уксусной кислоты. В каждую пробирку вносят по 0,02 мл крови, взятой капилляром от гемометра, и тотчас же смешивают содержимое пробирок, вращая их между ладонями.
В серологической пробирке (для эритроцитов) получают разведение крови в 200 раз, а в агглютинационной (для лейкоцитов) - в 20 раз.
Изучение счетной камеры Горяева и заполнение ее кровью для подсчета эритроцитов и лейкоцитов
Количество эритроцитов и лейкоцитов подсчитывают в специальных счетных камерах. Для этой цели пользуются счетной камерой Горяева, которая представляет собой стекло с нанесенными на него двумя сетками. Сетки отделены одна от другой углублениями и делятся разграничительными линиями на 225 квадратов. Площадь сетки 9 мм2, высота, создающаяся при притирании шлифованного покровного стекла в камере, 0,1 мм, объем 0,9 мм3. Перед заполнением камеры кровью ее моют водой и насухо вытирают.
К сухой поверхности камеры притирают шлифованное покровное стекло, плавно продвигая его по ней взад и вперед до появления цветных колец Ньютона в местах соприкосновения покровного стекла со стеклом камеры. Затем кровь в смесителе встряхивают в течение 1-2 минут, после чего из смесителя выпускают на ватку 1-2 капли крови, следующую каплю помещают перед шлифованным покровным стеклом. При нанесении капли крови надо следить за тем, чтобы в пространство над сеткой камеры не попал воздух и чтобы не было избытка жидкости. Одну сетку заполняют для подсчета эритроцитов, вторую - для подсчета лейкоцитов.
Для заполнения камеры Горяева кровью, взятой по способу Н. М. Николаева (пробирочный метод), поступают следующим образом. К счетной камере притирают шлифованное стекло. Из каждой пробирки, предварительно встряхнув ее, с помощью стеклянной палочки с оплавленным концом берут по одной капле жидкости и заполняют ими раздельно обе сетки камеры, для чего каплю помещают перед щелью, образующейся между шлифованным стеклом и счетной камерой, в результате чего жидкость заполняет пространство над сетками.
Подсчёт эритроцитов и лейкоцитов в счетной камере Горяева
Количество эритроцитов и лейкоцитов в камере Горяева подсчитывают с помощью микроскопа. Для этого заполненную разведенной кровью камеру Горяева помещают на предметный столик микроскопа и под малым увеличением (окуляр 15 X или 10Х, объектив 8Х), с опущенным конденсором находят сетку камеры. К подсчету форменных элементов приступают через 2-3 минуты после заполнения камеры кровью.
Эритроциты подсчитывают в пяти квадратах, каждый из которых разделен на 16 маленьких квадратиков. Подсчет начинают с левого верхнего квадрата, а затем продвигают камеру по диагонали сверху вниз. Во избежание повторного подсчета одних и тех же эритроцитов руководствуются следующим правилом: все эритроциты внутри квадратика и на разграничительных линиях подсчитывают только тогда, когда они большей своей половиной заходят внутрь квадратика; клетки, пересеченные разграничительной чертой пополам, подсчитывают лишь на двух сторонах из четырех сторон квадрата (на левой и верхней); клетки, выходящие большей своей половиной за пределы разграничительных линий, совсем не считают.
Результаты подсчета эритроцитов по каждому из пяти больших квадратов записывают и суммируют. Для расчета количества эритроцитов пользуются следующей формулой:
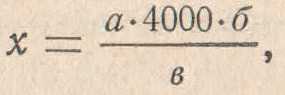
где х — количество эритроцитов в 1 мм3 крови; а — сумма эритроцитов, подсчитанных в пяти квадратах; б — разведение крови в 200 раз; в — количество сосчитанных маленьких квадратиков — 80.
Для упрощения расчета к количеству подсчитанных эритроцитов приписывают четыре нуля.
В норме количество эритроцитов от 4 500 000 до 5 000 000 в 1 мм3 крови.
Лейкоциты подсчитывают в 100 больших квадратах. При подсчете их руководствуются теми же правилами, которые указаны для эритроцитов, а затем производят расчет по приведенной выше формуле, в которой цифра разведения равна 20, а количество подсчитанных квадратов — 1600.
Для простоты расчета количество подсчитанных лейкоцитов умножают на 50 или делят на 2 и приписывают два пуля.
В норме количество лейкоцитов от 5000 до 8000 в 1 мм3 крови.
Чистка смесителей. После подсчета лейкоцитов смесители моют следующим образом: резиновой грушей удаляют остатки крови, после чего их многократно промывают дистиллированной водой, спиртом и просушивают эфиром или в сушильном шкафу. Показателем чистоты смесителей служит свободное передвижение бусинки при встряхивании смесителя.
В последнее время для подсчета эритроцитов и лейкоцитов пользуются целоскопом отечественного производства СФЭК-62, который позволяет быстро и точно определить количество форменных элементов в 1 мм3 крови.
Техника его использования подробно изложена в инструкции, приложенной к прибору.
Вычисление цветного показателя (цветной коэффициент)
Цветной показатель выражает среднее содержание гемоглобина в одном эритроците. В норме цветной коэффициент равняется 1,0 при 100% гемоглобина и 5 000 000 эритроцитов в 1 мм3 крови. Его рассчитывают исходя из следующей пропорции: найденное количество гемоглобина (в единицах) так относится к его нормальному количеству, как найденное количество эритроцитов к их нормальному числу.
Например, если найденный гемоглобин равен 88 ед., а количество эритроцитов 4 8000 000 в 1 мм3, то цветной показатель равен 0,91.
При количестве эритроцитов меньше 1 000 000 делить надо на две первые цифры подсчитанного числа эритроцитов. Цветной показатель в норме равен 0,9-1,1.
Определение содержания гемоглобина в одном эритроците (СГЭ)
В последнее время наряду с цветным показателем рассчитывают более достоверную абсолютную величину — содержание гемоглобина в одном эритроците - СГЭ. При расчете этого показателя весовое количество гемоглобина выражают в очень мелких единицах — микромикрограммах (мкмкг), или, что правильнее — пикограммах (пг).
СГЭ получают умножением количества гемоглобина в грамм-процентах на 10 и делением на число эритроцитов в миллионах.
Лабораторная камера Горяева , названная в честь русского врача, профессора Казанского университета Горяева Н.К., является специальным монолитным предметным стеклом, предназначенным для подсчета количества клеток в заданном объеме жидкости. Кроме того, используя камеру Горяева можно определить увеличение микроскопа. Камеры Горяева широко применяются в области клинических и биомедицинских исследований.
Популярные области применение камеры Горяева:
- Подсчет форменных элементов крови
- Подсчет эритроцитов
- Подсчет лейкоцитов
- Подсчет ретикулоцитов
- И т.п.
- Подсчет форменных элементов мочи
- Исследование эякулята – оценка количественных и качественных параметров сперматозодиов
- Вычисление концентрации спор в вакцине
- Подсчет ооцист в препарате
- И т.п.
Камеры Горяева выпускаются в двух модификациях: двухсеточные (двухкамерные) и четырехсеточные (четырехкамерные). В определении цены камеры Горяева важную роль играет качество шлифовки стекла, метод нанесения сетки – лазерная гравировка или же вакуумное напыление.
Что собой представляет камера Горяева? Камера Горяева есть не что иное, как прозрачное монолитное предметное стекло поперечными прорезями и нанесенной специальным образом микроскопической сеткой. В случае двухкамерной камеры Горяева мы имеем четыре прорези, образующие три поперечно расположенных площадки, при этом средняя площадка разделена продольной прорезью на две одинаковых камеры, на каждой из поверхности площадки которых нанесена сетка. В случае же четырехкамерной камеры Горяева мы получаем предметное стекло с пятью прорезями, образующих четыре площадки, при этом две внутренние дополнительно разделены продольной прорезью для получения четырех камер с нанесенной микроскопической сеткой на поверхности площадок.
Рассмотрим более подробно особенности сетки . Специальная сетка наносится на внутренние площадки, расположенные ниже соседних боковых площадок на 0.1мм. Боковые площадки предназначены для притирания покровного стекла до появления Ньютоновских колец. Как правило, используют специальное покровное стекло для камеры Горяева с закругленными краями. После притирания покровного стекла создается камера, закрытая с двух боковых сторон, а с двух других остаются щели (так называемые, капиллярные пространства), через которые и заполняют камеру. Что конкретно представляет собой сетка? Микроскопическая сетка камеры Горяева расчерчена на большие и маленькие квадраты, сгруппированные различными способами. Сетка Горяева содержит 225 больших квадратов (15 рядов по 15 больших квадратов в каждом), разграфленных вертикально, горизонтально, крест-накрест и неразграфленных. При этом размеры малых делений клетки сетки составляют 0.05мм, а больших – 0.2мм. Важно, что малый квадрат со стороной 0.05мм во всех сетках является постоянной величиной. Не трудно рассчитать, что площадь малого квадрата равна 0.0025 мм2, а большого квадрата – 0.04мм2. Тогда получаем, что объем жидкости над квадратом, образованным большими делениями сетки Горяева, составляет 0.004 микролитра.
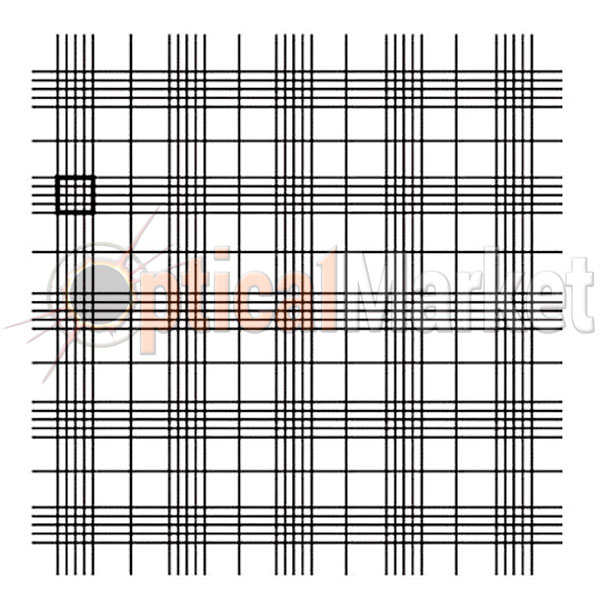
Подсчитав количество форменных элементов (ФЭ) над большим квадратом, можно подсчитать плотность данного типа клеток в суспензии по формуле:
где X - количество ФЭ/мл, M- количество ФЭ над большим квадратом.
При работе с камерой Горяева важно следить, чтобы ее рабочие поверхности оставались сухими и чистыми. Кроме того, при подсчете форменных элементов нельзя допускать наличие воздушных пузырей на сетке камеры, так как они могут мешать точности подсчета.
После работы с камерами Горяева следует выполнить их дезинфекцию одним из допустимых способов:
- Погружение в 70%-ный раствор этилового спирта на 30 минут
- Погружение в 4%-ный раствор формалина на 60 минут при комнатной температуре.
Приведем примеры применения камеры Горяева и некоторые формулы.
Практическое применение камеры Горяева
Прежде чем приступить к проведению лабораторных исследований, рекомендуется тщательно протереть камеру Горяева небольшим кусочком чистого бинта, слегка смоченного в спирте. Мы не советуем использовать для этих целей вату, так как она может оставить волокна. Таким же образом следует обработать и покровное стекло для камеры Горяева. Учтите, что при использовании низкокачественного спирта на поверхностях может образоваться осадок, тем или иным образом мешающий проведению исследований. Чтобы избежать появления связанных с этим явлением нежелательных эффектов, рекомендуется дополнительно протереть камеру и покровное стекло чистым марлевым шариком без спирта. Притирание покровного стекла к камере должно быть выполнено очень тщательно до появления на месте контакта радужных колец (так называемых, цветных колец Ньютона) с обоих краев. Для лучшего притирания можно воспользоваться одной хитростью и слегка выдохнуть воздух на камеру и покровное стекло, так чтобы небольшое количество влаги сконденсировалось на поверхностях стекол, что обеспечит лучший контакт.
При отсутствии специальных покровных стекол, прилагающихся к камере Горяева, можно использовать обычные стандартные покровные стекла.
Помимо целевого использования камеры Горяева для подсчета форменных элементов крови и т.п., данное стекло может расцениваться как своеобразный эталон для определения увеличения микроскопа. Для этого следует воспользоваться следующей формулой:
где X – это увеличение микроскопа; p1 – положение левой границы клетки камеры Горяева; p2 – положение правой границы клетки или группы клеток; N – количество клеток между измеряемыми границами; a - размер клетки камеры Горяева (равен 0,05 мм).
Камера Горяева также используется для подсчёта количества клеток в культуре.
Для подсчета клеточных элементов в жидкостях, содержащих их в меньших концентрациях, используются аналогичные по конструкции камеры Фукса-Розенталя и Нажотта , имеющие большую глубину – 0.2 мм и 0.5 мм соответственно. Эти же камеры используются в альгологии для количественного учета фитопланктона. Часто камера Фукса-Розенталя используется для подсчета форменных элементов спинномозговой жидкости. В отличие от камеры Горяева, большие квадраты сетки Фукс-Розенталя не разграфлены и сгруппированы по 16 квадратов, причем каждая такая группа ограничена тройными линиями.
Подсчет форменных элементов крови
Наиболее часто камеры Горяева используются именно для определения форменных элементов крови при проведении лабораторных исследований. Так для подсчета эритроцитов кровь необходимо развести в 200 раз, лейкоцитов – в 20 раз. Количество форменных элементов (ФЭ) в 1мкл крови определяют по формуле:
где N – искомое количество ФЭ в 1 мкл крови; m – число ФЭ в определенном количестве малых квадратов; q – количество малых квадратов сетки камеры Горяева, в которых подсчитывались ФЭ, s – степень разведения крови.
Формула для подсчета эритроцитов
Для подсчета эритроцитов используются 5 больших или 80 малых квадратов сетки, расположенных по диагонали. Таким образом, получаем следующую формулу:
N=m*4000*200/(5*16)=m*10000
Формула для подсчета лейкоцитов
Для подсчета лейкоцитов можно использовать один из трех методов:
1. Лейкоциты считают в 64 больших (пустых) квадратах
N=m*4000*20/(64*16)=m*78,125≈m*78
2. Лейкоциты считают по всей сетке в 169 больших квадратах (рекомендуется для образцов крови с выраженной лейкопенией)
N=m*4000*20/(169*16)≈m*29,6
3. Лейкоциты считают в 100 больших квадратах (64 пустых + 36 разграфленных квадратов по периметру сетки)
N=m*4000*20/(100*16)=m*50
Таблица нормальных значений:
Подсчет форменных элементов в мочевом осадке
Для определения ФЭ в мочевом осадке при анализах мочи по Нечипоренко, Аддис-Каковскому, Амбурже осуществляется по всей сетке Горяева и рассчитывается по формуле:
где N – число ФЭ в 1 мкл осадка; m – число ФЭ, подсчитанных по всей сетке; 0.676 – объем камеры Горяева (мкл)
Подсчет количества лейкоцитов крови может быть произведен в счетной камере Бюркера с сеткой Горяева или в электронно-автоматических анализаторах («Целлоскоп», «Культер», «Техникан»).
Методика подсчета в камере Бюркера с сеткой Горяева
Принцип метода: аналогичен таковому подсчету эритроцитов, суть его состоит в точном отмеривании крови и ее разведении в определенном объеме жидкости с последующим подсчетом клеточных элементов в счетной камере и пересчете полученного результата на 1 крови.
Оборудование и реактивы:
смесители или пробирки для подсчета лейкоцитов;
3% раствор уксусной кислоты, к которому прибавлено несколько капель метилвиолета или метиленового синего;
счетная камера;
микроскоп.
Смеситель для лейкоцитов отличается от такового для эритроцитов тем, что имеет более широкий просвет капилляра и меньший по величине резервуар. На смеситель нанесены три метки: 0,5, 1,0 и 11. Это позволяет развести кровь в 10 либо в 20 раз (чаще разводят в 20 раз).
Ход исследования: при взятии крови для подсчета лейкоцитов с кожи предварительно удаляют ватным тампоном остатки крови и, слегка сдавливая палец, выпускают свежую каплю крови. При работе со смесителями кровь набирают до метки 0,5, затем разводят 3 % раствором уксусной кислоты до метки 11. Энергично встряхивают в течение 3 мин, после чего сливают 1-2 капли и заполняют счетную камеру. При работе с пробирками для подсчета лейкоцитов наливают 0,4 мл 3% раствора уксусной кисло ты и в нее выпускают 0,02 мл крови, отмеренной пипеткой от гемометра Сали. Тщательно встряхивают пробирки, затем в жидкость опускают пипетку и, набрав содержимое, заполняют счетную камеру. Так как лейкоцитов гораздо меньше, чем эритроцитов, то для получения достоверного и точного результата подсчет производят в 100 больших (неразграфленных) квадратах. Обычно в одном большом квадрате находится 1-2 лейкоцита. Число лейкоцитов в 1 мкл крови рассчитывается аналогично расчету числа эритроцитов по формуле
X = (А х 4000 х В)/Б,
где X - количество лейкоцитов в 1 мкл крови; А - количество лейкоцитов, сосчитанных в 1600 малых квадратах; Б - количество сосчитанных малых квадратов (1600); 4000 - величина, умножая на которую, мы получаем количество клеток в 1 мкл.
Интерпретация полученных данных. Нормальное количество лейкоцитов: 4.0 – 9.0 х 10 9 /л. Уменьшение их числа в крови называется лейкопенией, увеличение - лейкоцитозом.
Лейкоцитоз может быть абсолютным (истинным) и относительным (перераспределительным).
Абсолютный лейкоцитоз – наблюдается при острых воспалительных процессах, некрозе тканей, острых бактериальных инфекциях (за исключением брюшного тифа, бруцеллеза, туляремии и др.), аллергических состояниях, злокачественных опухолях (с деструкцией тканей), закрытых травмах черепа и кровоизлияниях в мозг, диабетической и уремической коме, шоке, острой кровопотере, как первичная реакция – при лучевой болезни. Значительное повышение количество лейкоцитов встречается при лейкозах.
Относительный (перераспределительный) является следствием поступления лейкоцитов в ток крови из органов, служащих для нее депо. Это происходит после приема пищи (пищевой лейкоцитоз), горячих и холодных ванн, сильных эмоций (вегетососудистый лейкоцитоз), интенсивной мышечной работы (миогенный лейкоцитоз) и т.д.
Лейкопения. Лейкопения рассматривается как показатель угнетения функциональной способности костного мозга в результате воздействия токсических веществ (мышьяк, бензол и т.п.), некоторых медикаментов (сульфаниламиды, левомицетин, бутадион, иммуран, циклофосфан и т.п.), вирусов (гриппа, вирусного гепатита, кори и т.п.), микробов (брюшного тифа, бруцеллеза и т.п.), ионизирующей радиации, рентгеновского излучения и гиперспленизма (увеличение функции селезенки).
Лейкоцитоз и лейкопения редко характеризуются пропорциональным увеличением (снижением) суммарного числа лейкоцитов всех видов (например лейкоцитоз при сгущении крови); в большинстве случаев имеется увеличение (уменьшение) числа какого-либо одного типа клеток, поэтому применяют термины «нейтрофилез», «нейтропения», «лимфоцитоз», «лимфопения», «эозинофилия», «эозинопения», «моноцитоз», «моноцитопения», «базофилия».
При клинической оценке изменения количества лейкоцитов большое значение придается процентному соотношению отдельных форм лейкоцитов, то есть лейкоцитарной формуле.
Лейкоцитарная формула крови здорового человека:
Относительное количество Абсолютное количество
Базофилы……………………….0-1% 0-0,0650 х 10 9 /л
Эозинофилы…………………….0.5-5% 0,02-0,30 х 10 9 /л
Нейтрофилы: - миелоциты…………0% отсутствуют
Метамиелоциты……0% отсутствуют
Палочкоядерные…...1-6% 0,040-0,300 х 10 9 /л
Сегментоядерные….47-72% 2,0-5,5 х 10 9 /л
Лимфоциты……………………….19-37% 1,2-3,0 х 10 9 /л
Моноциты………………………….3-11% 0,09-0,6 х 10 9 /л
Подсчет лейкоцитарной формулы производят в окрашенных мазках периферической крови. Для правильной интерпрепатации результатов исследования лейкоцитарной формулы рекомендуется производить подсчет в абсолютных количествах, а не в относительных. Наиболее распространены методы окраски мазков по Романовскому-Гимзе, по Паппенгейму. Под иммерсией считают не менее 200 клеток, а затем выводят процентное соотношение отдельных видов лейкоцитов. Анализ лейкограммы с учетом других показателей крови и клинической картины является ценным методом обследования, помогает в постановке диагноза и определении прогноза заболевания.
Основные причины нейтрофилеза.
Острые бактериальные инфекции – локализированные и генерализованные.
Воспаление или некроз ткани.
Миелопролиферативные заболевания.
Интоксикация.
Лекарственные воздействия (кортикостероиды).
Острые кровотечения.
Основные причины нейтропении.
Инфекции – бактериальные (брюшной тиф, бруцеллез, туляремия, паратифы) и вирусные (инфекционный гепатит, корь, грипп, краснуха и другие).
Миелотоксические влияния и супрессия гранулоцитопоэза (ионизирующая радиация; химические агенты – бензол, анилин, ДДТ; лекарственные воздействия – цитостатики и иммунодепрессанты; витамин-В 12 -фолиеводефицитная анемия, острый алейкемический лейкоз, апластическая анемия).
Воздействие антител (иммунные формы) – гиперчувтвительность к медикаментам, аутоиммунные заболевания (СКВ, ревматоидный артрит, хронический лимфолейкоз), изоиммунные проявления (гемолитическая болезнь новорожденных).
Перераспределение и депонирование в органах – шоковые состояния, заболевания со спленомегалией и гиперспленизмом.
Наследственные формы (семейная доброкачественная хроническая нейтропения).
Основные причины эозинофилии.
Аллергические заболевания.
Хронические поражения кожи - псориаз, пузырчатка, экзема.
Опухоли (эозинофильные варианты лейкоза).
Другие заболевания – фибропластический эндокардит Леффлера, скарлатина.
В фазе выздоровления при инфекциях и воспалительных заболеваниях (благоприятный прогностический признак).
Причины эозинопении (анэозинофилии).
Повышенная адренокортикостероидная активность в организме.
Брюшной тиф.
Основные причины базофилии:
Хронический миелолейкоз и эритремия.
Основные причины моноцитоза.
Подострые и хронические бактериальные инфекции.
Гемобластозы – моноцитарный лейкоз, лимфогранулематоз, лимфомы.
Другие состояния – СКВ, саркоидоз, ревматоидный артрит, инфекционный моноцитоз; в период выздоровления от инфекций, при выходе из агранулоцитоза, после спленэктомии.
Снижение числа моноцитов имеет значение главным образом при оценке лимфоцитарно-моноцитарного соотношения при легочном туберкулезе.
Основные причины лимфоцитоза.
Инфекции – острые вирусные (инфекционный мононуклеоз, корь, краснуха, ветряная оспа), хронические бактериальные (туберкулез, сифилис, бруцеллез), протозойные (токсоплазмоз).
Гемобластозы (лимфолейкоз, лимфомы).
Другие заболевания - гипертиреоз, аддисонова болезнь, витамин-В 12 -фолиево-дефицитная анемия, гипо- и апластические анемии.
Лимфоцитопения наблюдается при СКВ, лимфогранулематозе, распространенном туберкулезе лимфоузлов, в терминальной стадии почечной недостаточности, острой лучевой болезни, иммунодефицитных состояниях, приеме глюкокортикоидов.
Увеличение или уменьшение числа отдельных видов лейкоцитов в крови может быть относительным или абсолютным. Если изменяется только процентное содержание того или иного вида лейкоцитов, то имеет место относительная нейтрофилия, относительная эозинопения и т.д. Увеличение или уменьшение абсолютного содержания какого-либо вида лейкоцитов, то есть количества данных клеток в единице объема крови, называют абсолютной нейтрофилией, абсолютной эозинопенией и т.д.
Сдвиг формулы влево (увеличение количества молодых форм нейтрофилов) – признак воспаления или некротического процесса в организме.
Сдвиг лейкоцитарной формулы вправо характерен для лучевой болезни и витамин-В 12 -фолиеводефицитной анемии.
Отсутствие или значительное снижение числа всех видов зернистых лейкоцитов – гранулоцитов (нейтрофилов, эозинофилов, базофилов) обозначают термином агранулоцитоз. В зависимости от механизма возникновения различают миелотоксический (воздействие ионизирующего излучения, прием цитостатиков) и иммунный (гаптеновый и аутоиммунный агранулоцитоз).
Принцип метода состоит в подсчете эритроцитов в камере Горяева. Для уменьшения концентрации форменных элементов и создания удобной для подсчета их концентрации кровь предварительно разводится стандартным образом.
Ход работы
Пипеткой отмерьте 4 мл разводящего раствора (3,5% раствор NaCl) и вылейте в сухую пробирку. Капилляр Сали обработайте раствором цитрата натрия.
Из прокола пальца (работа № 1) выпустите свежую каплю крови, приставьте к ней кончик капилляра Сали и наполните его до отметки 0,02. Это соответствует объему 0, 02 мл или 20 мкл. Вытрите кончик капилляра и выпустите кровь в пробирку с разводящим раствором. Полученное таким образом разведение крови - 1:200.
После тщательного перемешивания раствора крови небольшой каплей заполните подготовленную - с притертым стеклом камеру Горяева. Камеру перед заполнением промойте водой и насухо вытрите. На участок камеры, где нанесены сетки, уложите обезжиренное покровное стекло, при этом нижняя поверхность камеры должна находиться на третьих пальцах обеих рук, двумя вторыми пальцами придерживайте ее спереди. Двумя пальцами притрите покровное стекло, плавно продвигая его по поверхности прямоугольных пластинок до появления цветных колец Ньютона в местах соприкосновения покровного стекла с поверхностью пластинок камеры.
Каплю исследуемой жидкости пипеткой поместите перед щелью, образованной покровным стеклом и пластинкой камеры Горяева с нанесенной сеткой. Капля должна заполнить камеру самотеком (под действием капиллярных сил). Следите, чтобы в пространстве над сеткой не было пузырьков воздуха и избытка жидкости.
До начала подсчета оставьте счетную камеру на 1 - 2 мин для осаждения форменных элементов. Камеру положите на столик микроскопа и настройте его на малое увеличение (объектив 8 - 9, окуляр 10 или 15). Подсчет производите при несколько опущенном конденсоре. Хорошую контрастность обеспечивает фазово-контрастное устройство. Эритроциты считайте в пяти больших квадратах, состоящих из 16 малых (5 16 = 80 малых), расположенных по диагонали. Для записи результатов рекомендуется предварительно расчертить на листе 5 больших квадратов, разлинованных 4х4 и записывать найденное число эритроцитов в каждую клеточку. При подсчете необходимо помнить правило буквы «Г».
Подсчитав число эритроцитов в 80 маленьких квадратах (N) рассчитывают число клеток в 1 мкл (мм 3) крови (X). Для этого учитывается разведение в 200 раз, объем камеры над одним маленьким квадратиком 1/4000 мкл и то, что клетки подсчитывались в 80 таких квадратах. Таким образом, формула для вычисления количества эритроцитов следующая:
Х=(N х4000х200)/80
Полученное количество эритроцитов можно также выразить в количестве на 1л крови (умножением полученного количества на 10 6), что является стандартной размерностью этого показателя.
Рекомендации по оформлению протокола работы. Выводы делаются исходя из того, что в норме количество эритроцитов должно составлять: 3,6-4,5 х 10 12 кл/л для женщин; 4,5 - 5 х 10 12 кл/л - для мужчин. После небольшой нагрузки – 5 - 5,5 х 10 12 кл/л.
Сразу после рождения количество эритроцитов составляет около 6,0 х 10 12 кл/л (колебания в пределах 5,4 - 7,2 х 10 12 кл/л). С конца первых - начала вторых суток жизни обычно происходит снижение числа эритроцитов в крови, наиболее выраженное на 5 - 7-й день. Минимального значения этот показатель достигает к 2 - 3 мес, а затем несколько увеличивается и в дальнейшем (с 5 - 6-го месяца) поддерживается на уровне взрослых.
Если количество эритроцитов выше нормы, то это явление называется эритроцитоз , а если меньше, то эритропения или анемия . Увеличение количества эритроцитов в крови (эритроцитоз) встречается при гемоконцентрации (ложный эритроцитоз), а также при усилении эритропоэза на фоне неизменной интенсивности гемолиза (истинный эритроцитоз). Уменьшение количества эритроцитов в крови может наблюдаться при гемодилюции (ложная эритропения).